【別紙】
タンパク質修復のための遺伝子誘導メカニズムを解明
【ポイント】
異常タンパク質を修復するための遺伝子発現誘導機構を解明
新規誘導機構は異常タンパク質の細胞内蓄積を抑制する
【概要】
わたしたちは加齢とともに様々な病気に罹患しやすくなります。細胞レベルでも、加齢は細胞機能の低下を導き、多様な異常に適応できなくなります。細胞内の構成成分のうち最も多いタンパク質は、加齢とともに異常な立体構造を持つタンパク質が蓄積するようになり、アルツハイマー病などの神経変性疾患へ罹患しやすくなります。今回、中井教授らの研究グループは、細胞内の異常タンパク質を修復するための遺伝子誘導メカニズムを世界で初めて発見しました。さらに、この複合体の形成ができない条件下では、異常タンパク質の蓄積の亢進とそれによる細胞死の増加が引き起こされました。したがって、この複合体の発見は、加齢と関連する神経変性疾患などの治療薬の開発に結びつく可能性があります。
【背景】
細胞は、外的環境や代謝の変化によって生じたミスフォールディングタンパク質に対処できる容量(プロテオスタシス容量)を遺伝子発現により調節する仕組みを備えています。その中で、生物に普遍的な仕組みの一つが熱ショック応答であり、タンパク質フォールディングを介助する熱ショックタンパク質群(HSP70他)が急速に、なおかつ顕著に誘導されます。哺乳動物細胞において、この応答を転写レベルで制御するのが熱ショック転写因子HSF1(注1)であり、HSF1はプロテオスタシス容量調節(注2)の鍵因子と言えます。HSF1活性は老化とともに低下し、その活性は老化と関連するタンパク質ミスフォールディング病(アルツハイマー病などの神経変性疾患群)の進行を抑制します。一方、がん細胞内はタンパク質がミスフォールディングしやすい環境にあり、がんの発症や進展はHSF1依存性です。したがって、HSF1は神経変性疾患やがんの治療ターゲットとして注目されています。
HSF1は不活性型としてあらかじめ細胞内に存在し、熱ストレスにより三量体へと転換してHSP70プロモーターへ結合します。この活性型HSF1は、基本転写因子群とメディエーターをひき寄せることで、それらと相互作用するRNAポリメラーゼII(Pol II)を急激にリクルートすることが知られています。しかし、基本転写因子群とメディエーターは、Pol IIを含む転写開始前複合体(PIC : Pre-initiation complex)(注3)を構成する一般的な転写装置であり、熱ショック応答に特異的な分子機構は知られていませんでした。
【研究の成果】
研究グループはこれまでにHSF1転写複合体の同定と解析を行ってきたが、基本転写因子群やメディエーターなどの一般的な転写装置の同定には至っていませんでした。今回、マウス細胞を用いて、HSP70プロモーターDNAに結合したHSF1転写複合体の構成因子を質量分析により同定することで、転写装置の構成因子群に加え、染色体分配に関与するシュゴシン(SGO2)(注4)を同定しました(図1、図2)。そして、SGO2がHSP70転写の熱誘導を促進することを見出しました(図3)。
さらに、SGO2の相互作用タンパク質の質量分析による解析から、Pol IIの主要な構成因子群を同定しました(図4)。そして、HSF1-SGO2-Pol IIの相互作用によるによるPol IIのリクルートとPIC形成の促進が、HSP70転写誘導に重要であることを明らかにしました(図5)。
これらの相互作用は、熱ストレス条件下での細胞生存、およびプロテオスタシス容量の回復を促進しました(図6)。さらに、発熱レベルの温熱ストレス条件下での異常タンパク質の蓄積も抑制し、生理的な条件下でプロテオスタシス容量の維持に重要であることが分かりました(図7)。
以上の結果は、SGO2の間期における転写過程の役割を明らかにすると同時に、タンパク質修復のための遺伝子の転写誘導にはSGO2を介するPol IIリクルートが重要であることを示します(図8)。
【研究の意義と今後の展望】
1) 転写過程での熱ストレス特異的なPol IIリクルート機構の解明
一般に、遺伝子プロモーターへ結合した転写因子は、基本転写因子群とメディエーターをひき寄せることでPol IIリクルートを促進します。申請者らは、マウス細胞を用いて、熱ストレス応答特異的にHSF1がSGO2を引き寄せることがPol IIの急激なリクルートに寄与していることを示しました。
2) SGOの転写における役割の解明
動原体周辺に局在することが知られているシュゴシン(SGO1とSGO2)は、アダプターとして働くことで正常な染色体分配に必要であることが知られています。そのような背景で、マウス細胞において、細胞周期の間期にSGO2がHSP群の遺伝子発現を促進することをはじめて明らかにしました。
3) HSF1-SGO相互作用は神経変性疾患の治療ターゲットとなることを提案
本研究により、HSF1-Ser326のリン酸化がSGO2を引き寄せて熱ショックタンパク質の発現を誘導することを明らかにしました。したがって、HSF1-Ser326リン酸化およびSGO2がタンパク質の凝集を病態とする神経変性疾患の治療ターゲットとなることを示しました。
<論文情報>
Takii R, Fujimoto M, Matsumoto M, Srivastava P, Katiyar A, Nakayama KI, and Nakai A. The pericentromeric protein shugoshin 2 cooperates with HSF1 in heat shock response and RNA Pol II recruitment. EMBO J. e102566, 2019
DOI: 10.15252/embj.2019102566
<問い合わせ先>
国立大学法人山口大学大学院医学系研究科医化学講座
中井 彰
瀧井 良祐
TEL: 0836-22-2215 FAX: 0836-22-2315
<補足説明>
(注1)熱ショック転写因子1(HSF1)
ある生育温度で維持されている細胞を数度高い温度にさらすと、タンパク質の異常を修復する熱ショックタンパク質が誘導される。この応答は熱ショック応答とよばれ,これを転写(DNAからRNAへの読み取り)のレベルで調節するのが熱ショック転写因子1(HSF1)である。HSF1はシャペロンとして働く熱ショックタンパク質(heat shock protein : HSP)群の主要な制御因子であり、その異常は神経変性疾患やがんと関連することが知られている。
(注2)プロテオスタシス容量
細胞がその機能を正しく発揮するためには、細胞内タンパク質の構造と濃度を含むすべてが一定に保たれる必要がある。このような細胞内タンパク質のバランスは、タンパク質の合成、折りたたみ、分解の3過程によって維持されており、この3つのバランスを維持することをタンパク質ホメオスタシス(プロテオスタシス)と呼ぶ。また、異常タンパク質に対処できる細胞の能力はプロテオスタシス容量と呼ばれる。
(注3)転写開始前複合体(transcription preinitiation complex : PIC)
DNAからRNAを転写する際に、遺伝子の転写開始部位にRNA polymerase II (Pol II) を含む転写開始前複合体(PIC)の集合が必要となる。まず、TATAボックス配列へのTATAボックス結合タンパク質(TBP)の結合を足掛かりに、基本転写因子群(general transcription factors: GTF)が呼び込まれる。基本転写因子群は、TFIIA、TFIIB、TFIID 、TFIIE、TFIIF、TFIIHで構成される多量体タンパク質で、Pol IIと相互作用し、その転写開始位置へのリクルートを助ける。メディエーターもPol IIと相互作用することでPIC形成を介助する。
(注4)シュゴシン
細胞が分裂する際に、DNAが複製される過程 (S期) を経て、M期 (細胞分裂期) に1本1本の染色体DNAが娘細胞に均等に分配される。M期での染色体分配期において、まず2本の染色体は、コヒーシンによって束ねられており、その後、中央のセントロメア領域を残して、コヒーシンは除去される。一方、セントロメア領域では、シュゴシン複合体がコヒーシンの分解を抑制しており、正常な染色体の分配が行われる。図2参照。
<図と説明>

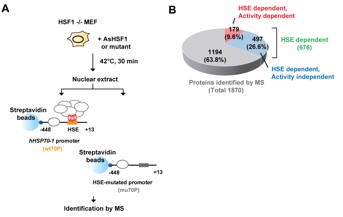
図1 HSF1転写複合体の同定
(A) HSF1転写複合体に含まれる構成因子群を明らかにするために、HSF1欠損マウス線維芽細胞 (MEF)に、数種の変異型HSF1を高発現した細胞を用意し、その細胞に42度 30分の熱処理を加えた後に細胞抽出液を用意し、ヒトHSP70プロモーターDNAに結合するタンパク質群を網羅的に解析した。 (B)その結果、全体で1,870の因子群が同定でき、HSF1の活性と関係があったのは179因子であった。
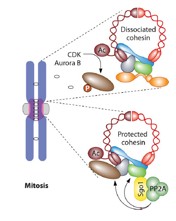
図2 染色体DNAとシュゴシンの役割
複製された染色体DNAは分裂期に均等に娘細胞に分配される。その過程において、シュゴシンはセントロメアでのコヒーシンの分解を抑制する。哺乳動物では、細胞分裂のM期にシュゴシン1(SGO1)が、生殖細胞での減数分裂期にシュゴシン2(SGO2)がコヒーシンの制御因子として働くと知られている。 (Marston AL, Mol. Cell. Biol. 2015 を改変)
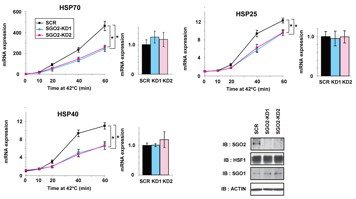
図3 SGO2はHSP群の転写誘導を促進する
HSF1の活性と特に関連するShugoshin2 (SGO2)に着目した。MEF細胞に42度の熱刺激の処理を行うと熱ショックタンパク群 (HSPs) が誘導されるが、その誘導はコントロール (SCR) に比べ、内在性のSGO2をノックダウン (KD1またはKD2)することで、約半分から8割程度まで減少する。
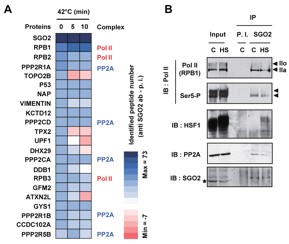
図4 SGO2の相互作用タンパク質の同定
(A) SGO2は42度の熱刺激の有無に関わらず、常にRNA polymerase II (Pol II) や脱リン酸化酵素群 (PP2A) と相互作用を示す。(B) 抗SGO2抗体を用いた免疫沈降法の結果、SGO2はPol IIの低リン酸化型 (IIa) と結合することが分かる。
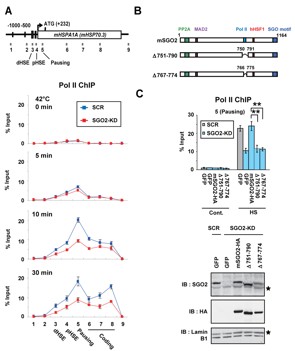
図5 SGO2依存的なPol IIの染色体への結合量の変化
(A) 42度の熱刺激 (0, 5分, 10分, 30分) は、染色体上のHSP70の転写開始点やその下流にPol IIの集積を引き起こす(青)。一方、SGO2をノックダウン (SGO2-KD) することで、その集積はコントロール (SCR) の約半分程度に減少する(赤)。 (B) Pol IIと結合するSGO2の領域は751-790内の767-774である。 (C) 内在性のSGO2をノックダウン (SGO2-KD) した後に、野生型およびPol IIと結合できないSGO2変異体 (751-790または767-774) を導入した細胞では、野生型 (mSGO2-HA) に比較し、Pol IIの集積が約半分に低下する。
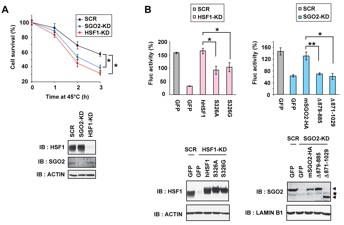
図6 細胞死やタンパク質の再折りたたみへのSGO2の役割
(A) SGO2が熱による細胞死に影響するかどうか検討した。45度の強い熱条件下では、コントロール (SCR : 60%) に対し、SGO2ノックダウン (SGO2-KD : 40%) MEF細胞では細胞死がより生じた。 (B) 熱はタンパク質の高次構造の変性を引き起こすが、37度に2時間置くと変性したタンパク質は元の立体構造へ戻る。この過程でのルシフェラーゼタンパク質(Fluc)の再折りたたみをその活性を指標として調べた。SGO2と結合できないhHSF1-S326変異体 (S326AやS326G) ではその活性が野生型 (hHSF1) に比較し約60%に低下する(左)。また、HSF1と結合できないSGO2変異体 (D879-885やD871-1029) においても野生型 (mSGO2-HA) に比較し、約半分に低下する(右)。この結果は、HSF1とSGO2間の結合が熱刺激に対する細胞のプロテオスタシスの維持に必要であることを示す。
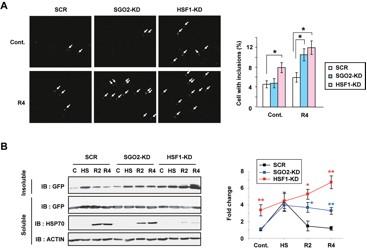
図7 SGO2は変成しやすいタンパク質の凝集体形成を抑える
(A) 41度の緩やかな熱刺激は、熱ショック応答を亢進させる。熱刺激4時間後での変成しやすいポリグルタミン81-GFPの凝集体は、SGO2ノックダウン (SGO2-KD) やHSF1ノックダウン (HSF1-KD) で亢進する。(B) 熱ストレス条件下でのポリグルタミン81-GFP不溶性タンパク質 (Insoluble) の蓄積は、野生型 (SCR) に比較し、SGO2ノックダウン (SGO2-KD) とHSF1ノックダウン (HSF1-KD) では低下していた。
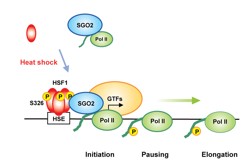
図8 SGO2を介した熱ショック応答の促進
マウス細胞では、熱刺激はHSF1の3量体への変換を促進し、RNA polymerase II(Pol II)を染色体上に集積させることで、転写誘導を促進する。その機構として、熱依存的なHSF1の326番目のセリンのリン酸化が起こり、そこにPol IIと結合したSGO2が集積する。